炎症反应上游调控细胞因子---HMGB1
2024-06-11 907
HMGB1(High mobility group box-1 protein,高迁移率族蛋白B1)是存在于真核细胞核内的非组蛋白染色体结合蛋白,参与DNA损伤修复和基因组稳定性维持。HMGB1属于HMG蛋白家族,因其在聚丙烯酞胺凝胶电泳(PAGE)中迁移速度快且没有聚集迹象而得名。HMG家族包含HMGB、HMGN和HMGA三个高度保守的核蛋白亚家族。与其他同家族蛋白相比,HMGB1存在范围更广,在哺乳动物的几乎所有细胞和组织内均有表达。
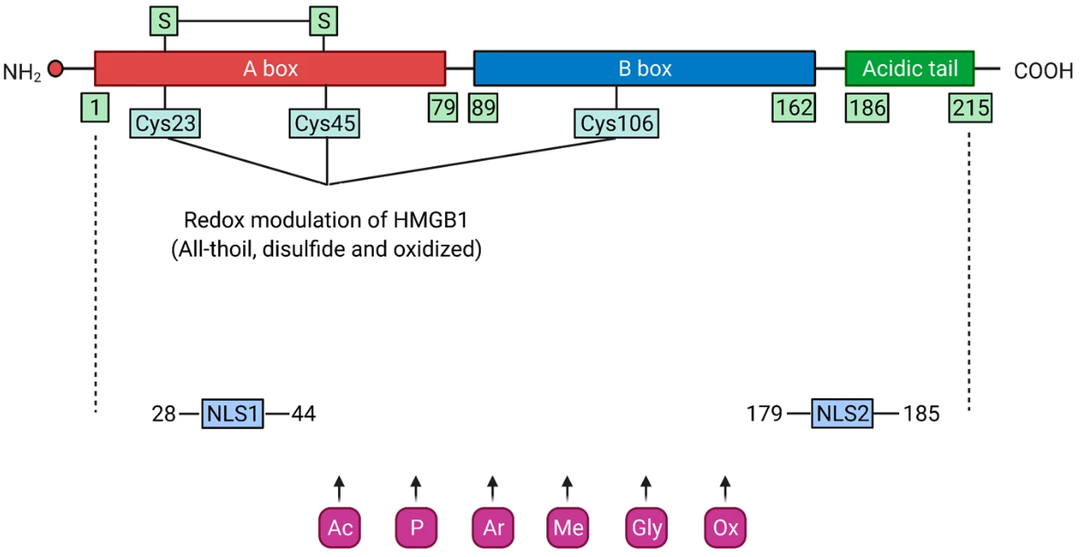
HMGB1结构 HMGB1是一个高度保守的含有215个氨基酸残基的单链多肽,N端富含带正电荷的赖氨酸,C末端富含带负电荷的天门冬氨酸和谷氨酸,又称酸性尾巴,分子量约为24894 Da。从氨基端到羧基端的结构依次为9-79氨基酸残基的A box,95-163氨基酸残基的B box和186-215仅含谷氨酸和天冬氨酸残基的受体结合模体。结构功能分析显示HMGB1的B box是发挥炎症的功能区域,而A box是B box的拮抗位点。 HMGB1被认为是一种结构染色质结合因子,参与核小体结构的维持和基因转录,具有维持染色质稳定和参与细胞DNA重组等多种生物功能。而细胞外HMGB1也调控多种生物过程,如细胞分化,细胞迁移和转移,细胞凋亡和炎症反应等。研究表明,细胞外HMGB1可作为DAMP激活先天免疫系统,募集炎症细胞和平滑肌细胞,刺激巨噬细胞和内皮细胞产生促炎细胞因子,促进炎症反应。此外,细胞外HMGB1作为一种免疫分子,可触发免疫细胞和内皮细胞的炎症反应,随后,被HMGB1激活的免疫细胞和内皮细胞可以分泌HMGB1,形成一个正反馈回路。因此,HMGB1可以在多种刺激条件下维持长期的炎症状态。 HMGB1参与多种疾病的病理发展,且在多种疾病中高度表达,包括:无菌炎症、自身性免疫疾病、败血症及失血性休克,癌症等。如图4所示,HMGB1是损伤相关分子模式(DAPM)的重要分子。通过DAPM,HMGB1可介导炎症并在例如系统性红斑狼疮(SLE)、类风湿关节炎(RA)加重炎症性疾病,以及在癌症中激活免疫原性细胞死亡,从而激活肿瘤特异性免疫反应中发挥病理作用。 自身免疫性疾病中的代表性损伤相关分子模式(DAMP) HMGB1与炎症和自身性免疫疾病 长期以来,病原体被认为是引起炎症反应的主要原因。当病原体入侵人体时,会激发免疫系统引起炎症反应。而针对由创伤和自身免疫性疾病引起的炎症反应,根据Matzinger提出的“危险信号学说”,HMGB1被认为是作为 “损伤相关分子模式(DAMPs)”,由 “模式识别受体(PRRs)” 识别所引起的免疫应答而产生的多种无菌炎症和自身免疫疾病的重要免疫原。 系统性红斑狼疮(SLE)、类风湿关节炎(RA)病人的血清中均有HMGB1抗体的存在:研究人源分别在皮肤红斑狼疮(CLE)患者的表皮和真皮细胞外,以及干燥综合症(SS)患者的小唾液腺标本中检测到了HMGB1浓度的增高,而在关节炎患者的滑膜活检标本中发现HMGB1在细胞外浓度同样较高。实验显示给患有类风湿性关节炎的大鼠直接注射HMGB1抗体,大鼠的关节炎症状明显好转。此外HMGB1还与其他以细胞死亡和损伤为特征的疾病有关,包括糖尿病和阿尔茨海默氏病。 HMGB1在败血症和失血性休克中高表达 研究显示,正常人血清HMGB1含量极低,而在败血症和失血性休克患者的血清中表达水平显著增高,且死亡组HMGB1水平高于存活组。由败血症所引发的死亡常发生在致炎细胞因子已经恢复到基础水平后,在巨噬细胞受TNF刺激8小时后开始分泌HMGB1,在18小时后达到峰值。在此期间HMGB1本身也刺激了其他致炎因子的释放,例如受HMGB1刺激的巨噬细胞可增加合成TNF数量以及TNF mRNA的表达量;单核细胞受HMGB1刺激后可释放TNF, IL-1α、IL-1β、IL-6, IL-8, MIP-1α、Nip-1β;中性粒细胞受HMGB1刺激后,其TNF, IL-1、IL-8分泌量增加。 失血性休克患者在休克后24小时内HMGB1增高,72小时达到峰值,96小时开始下降。患者血压恢复和临床症状改善后,血清中HMGB1则恢复到了正常水平。 HMGB1在癌症中的双重作用 HMGB1在肿瘤微环境(TME)中具有双重作用:HMGB1既可以对肿瘤产生促进其生长、肿瘤血管生成、免疫抑制、促进侵袭和转移等促癌作用;相反的是,HMGB1还可激活免疫原性细胞死亡(ICD),提高抗肿瘤免疫力,起到抗癌的作用。 细胞外HMGB1可促进肿瘤细胞的生殖分化和迁移:临床检测表明,由于HMGB1和其受体RAGE在肿瘤细胞表面均高度表达,通过与其受体RAGE结合可发挥趋化性作用。在包括非霍奇金淋巴瘤,肝癌,黑色素瘤,胃癌,胰腺癌,宫颈癌,乳腺瘤,骨肉瘤,间皮瘤,结直肠癌等肿瘤中的表达与肿瘤的发生发展,病灶大小,浸润及淋巴转移均相关。 而在另一方面,HMGB1可激活免疫原性细胞死亡 (Immunogenic cell death, ICD)。ICD 是由垂死的肿瘤细胞释放损伤相关分子模式(DAPM),从而激活肿瘤特异性的免疫反应。如图4所示,HMGB1是DAMP最关键的分子,可促进树突细胞(DC)成熟,进而活化细胞毒性T细胞(CTL),促使CTL杀死肿瘤细胞。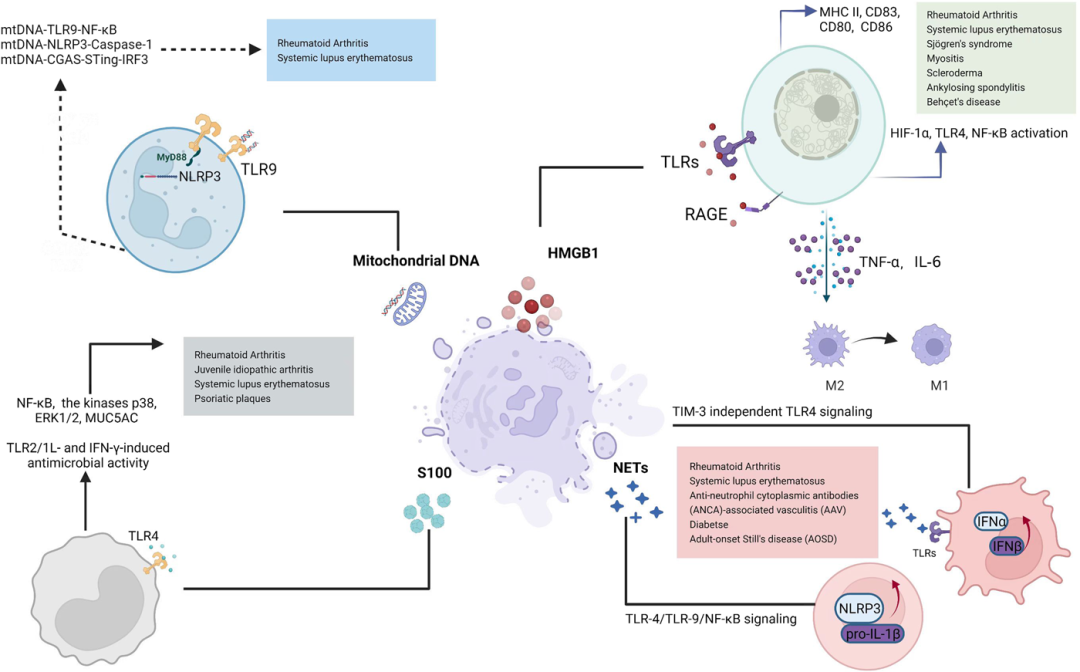

 销售咨询1
销售咨询1
